-
Используя метод электронного баланса Расставьте степени окисления, Укажите окислитель и восстановитель Расставьте коэффициенты.
Cu+HNO3=Cu(NO3)2+NO+H2O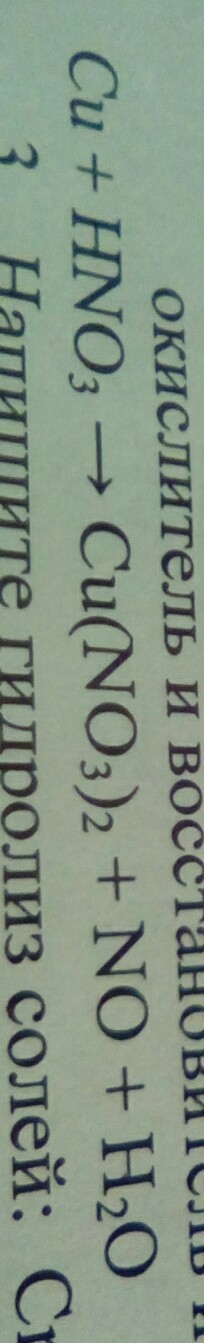
Ответы 2
-
спасибо)
-
Автор:
joel10 - 6 лет назад
-
0
-
-
Cu(0)+H(+1)N(+5)O3(-2)=Cu(+2)(N(+5)O3(-2)+N(+2)O(-2)+H2(+1)O(-2)- в скобках со знаками их с.оСu(O) - 2e = Cu(2+) /2/3 восстановитель, р. окислениеN(+5) +3e = N(+2) /3/2 окислитель, р восстановление3 Cu + 8 HNO3 = 3 Cu(NO3)2 + 2 NO + 4 H2O
-
Автор:
hester - 6 лет назад
-
0
-
-
Добавить свой ответ
Еще вопросы
- Характерні інтервали в соль мажорі мі мінорі фа мажорі і ре мінорі
-
Найдите наименьшее из чисел
tg п/3
tg ( -п/4)
tg 2п/3
tg 3п/4-
Предмет:
Алгебра -
Автор:
mirandaznxl - 6 лет назад
-
Ответов:
1 -
Смотреть
-
-
4(0,2-3х)+8х=
если х=-0,25,то.. -
запишите два каких-либо многозначных числа которые делятся на 2 10 9 5 3 и 6
-
Предмет:
Математика -
Автор:
ciscoucpq - 6 лет назад
-
Ответов:
1 -
Смотреть
-
How much to ban the user?
1 hour
1 day
100 years
