-
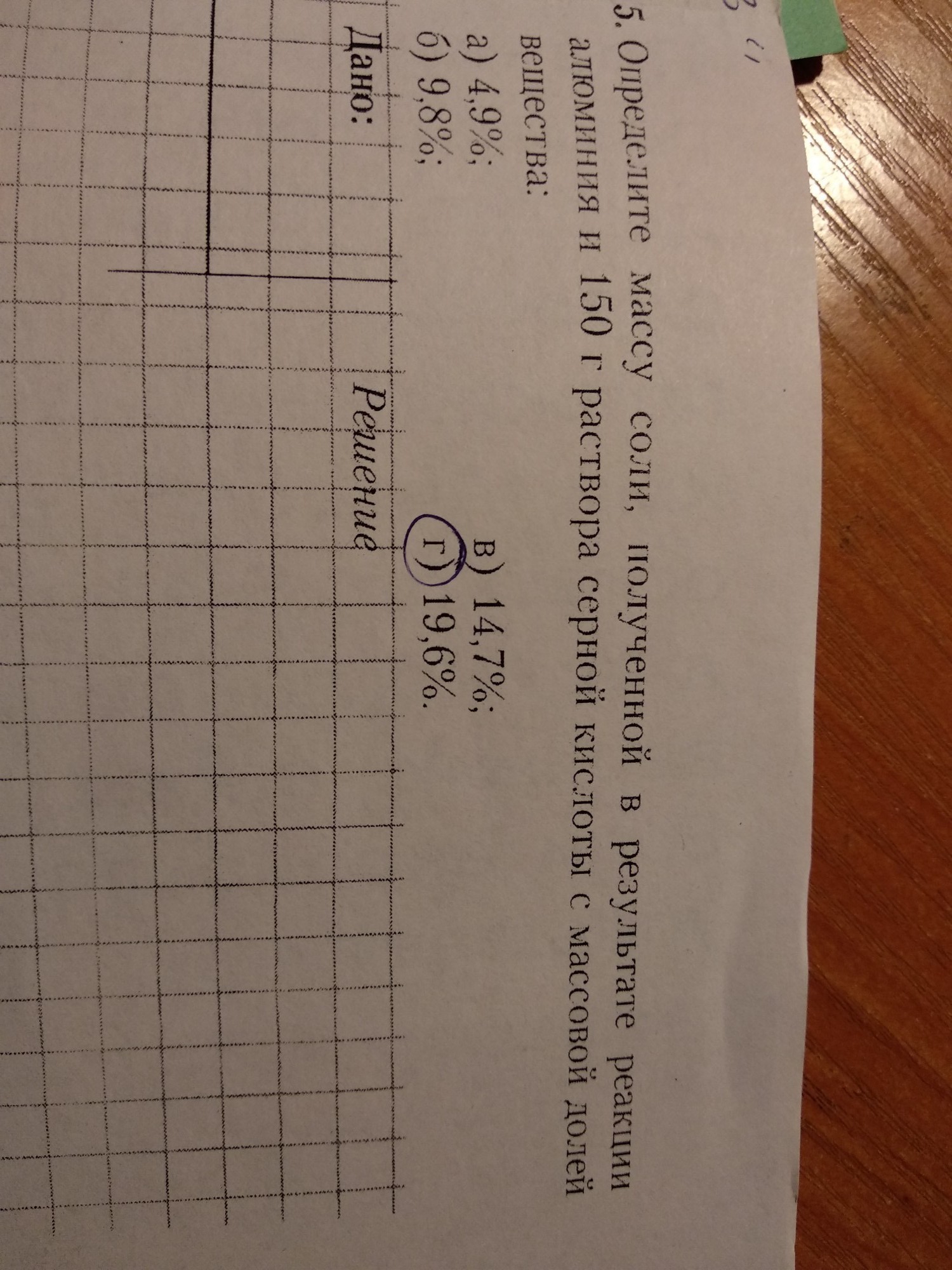
определите массу соли полученной в результате реакции алюминия и 150 г раствора серной кислоты с массовой долей вещества 19, 6%. Помогите пожалуйста решить)
-
Предмет:
Химия -
Автор:
danika3ysa - 6 лет назад
-
Ответы 5
-
Вам понятно решение или есть вопросы?
-
Автор:
noble - 6 лет назад
-
0
-
-
всё понятно, спасибо большое)
-
Автор:
gwendolen9ohr - 6 лет назад
-
0
-
-
Удачи!
-
Автор:
joaquin566 - 6 лет назад
-
0
-
-
спасибо
-
Автор:
leohiwc - 6 лет назад
-
0
-
-
Дано:
m(раствораH₂SO₄)=150г.
ω%((H₂SO₄)=19,6%
----------------------------------------
m[AI₂(SO₄)₃]-?
1. Определим массу серной кислоты в 150г. с массовой долей 19,6% :
m(H₂SO₄)=ω%((H₂SO₄) x m(раствораH₂SO₄) ÷100%= 19,6%х150г.÷100%=29,4г.
2. Определим молярную массу серной кислоты и ее количество вещества в 29,4г.:
M(H₂SO₄)=1x2+32+16x4=98г./моль
n(H₂SO₄)=29,4г÷98г./моль=0,3моль
3. Запишем уравнение реакции. Проанализируем его и соотнесем с данными в задаче:
2AI + 3H₂SO₄ = AI₂(SO₄)₃ + 3H₂
По уравнению реакции из 3моль серной кислоты образовался 1моль соли сульфата алюминия, значит из 0,3моль серной кислоты образуется 0,1моль соли сульфата алюминия.
n[AI₂(SO₄)₃]=0,1моль
4. Определим молярную массу сульфата алюминия и его массу количеством вещества 0,1моль:
M[AI₂(SO₄)₃] = 27x2+(32+16x4)x2=54+192=246г./моль
m[AI₂(SO₄)₃] = n[AI₂(SO₄)₃] x M[AI₂(SO₄)₃] = 0,1мольх246г./моль = 24,6г.
5. Ответ: из 150 г раствора серной кислоты с массовой долей вещества 19, 6%. при взаимодействии с алюминием образовал 24,6г. сульфата алюминия.
-
Автор:
norris67 - 6 лет назад
-
0
-
-
Добавить свой ответ
-
Помогите решить все хто пожалуйста:)
-
Предмет:
Химия -
Автор:
ubaldofv3m - 6 лет назад
-
Ответов:
6 -
Смотреть
-
-
В первом ящике было 62 кг яблок, что на 18 кг больше, чем во втором ящике. Сколько яблок было во втором ящике?
-
Предмет:
Математика -
Автор:
boozer - 6 лет назад
-
Ответов:
2 -
Смотреть
-
-
Перевести число B3E5916 в десятичную систему счисления.
-
Предмет:
Информатика -
Автор:
adela - 6 лет назад
-
Ответов:
1 -
Смотреть
-
-
Народ,помогите пожалуйста с номером 1188. Завтра возможно к/р будет по данной теме,а я эти примеры не понимаю. Надеюсь,вы объясните мне. Люди, которые не знают,как это делать,не спамьте пожалуйста.
-
Предмет:
Алгебра -
Автор:
shasta5jgo - 6 лет назад
-
Ответов:
2 -
Смотреть
-
