-
Помогите решить окислительно восстановительные реакции методом электронного баланса?
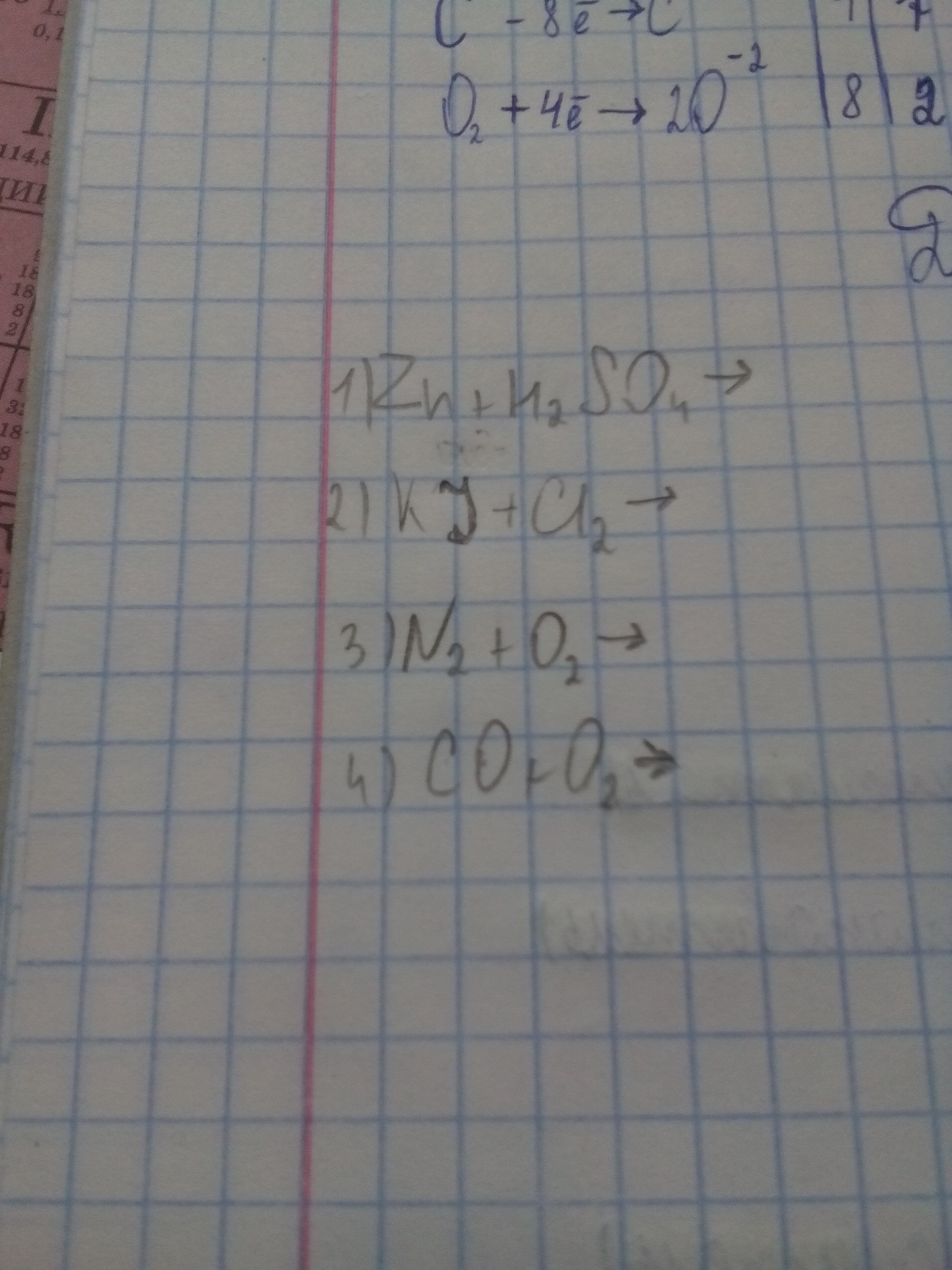
Ответы 1
-
1)a)Zn+H2SO4(разб.)=ZnSO4+H2↑Zn(0)-2e=Zn(2+) окисление \12H(+)+2e=H2(0) восстановление /1Zn(0) - восстановительH(+) - окислительб)Zn+2H2SO4(конц.)=ZnSO4+SO2+2H2OZn(0)-2e=Zn(2+) окисление \1S(6+)+2e=S(4+) восстановление /1Zn(0) - восстановительS(6+) - окислитель2)2KI+Cl2=2KCl+I22I(-1)-2e=I2(0) окисление \1Cl2(0)+2e=2Cl(-1) восстановление /1 I(-1) - восстановительCl2(0) - окислитель3)N2+O2---(электричество)⇒ 2NON2(0)-4e=2N(2+) окисление \1O2(0)+4e=2O(2-) восстановление /1N2(0) - восстановительO2(0) - окислитель4) 2СО+О2=2СО2С(2+)-2е=С(4+) окисление 1О2(0)+2е=2О(2-) восстановление 1С(2+) - восстановительО2(0) - окислитель
-
Автор:
regina72 - 6 лет назад
-
0
-
-
Добавить свой ответ
Еще вопросы
-
в классе 12 мальчиков и 11 девочек . учитель планирует отобрать 3 мальчиков и 3 девочек для работы над коллективным школьным проектом .
сколькими способами он может это сделать ?
нужен ответ с решением !-
Предмет:
Алгебра -
Автор:
hunter9mdj - 6 лет назад
-
Ответов:
5 -
Смотреть
-
-
найдите сумму овозможных остатков от деления на 28 натуральных чисел, делящихся на 7 без остатка
-
Предмет:
Математика -
Автор:
ricardo76 - 6 лет назад
-
Ответов:
1 -
Смотреть
-
-
Найдите НОД чисел:
в)60,80,48.
б)195,156,260.
-
Предмет:
Математика -
Автор:
dexterdcga - 6 лет назад
-
Ответов:
1 -
Смотреть
-
-
звуковой анализ слова "зима"
-
Предмет:
Русский язык -
Автор:
osvaldo - 6 лет назад
-
Ответов:
2 -
Смотреть
-
How much to ban the user?
1 hour
1 day
100 years
